Исследуемый материал
Цельная кровь (с ЭДТА)
Метод определения
Real-Тime PCR.
Диагностический критерий Всемирной организации здравоохранения (ВОЗ) для ХМПЗ. Молекулярно-генетическая диагностика. Количественное определение является важным для оценки ответа больных на терапию, для мониторинга динамики заболевания.
Миелопролиферативные заболевания (МПЗ) – заболевания, характеризующиеся избыточной пролиферацией (выработкой клеток) одного или нескольких ростков кроветворения. Нарушения возникают на уровне стволовых клеток. Классические Ph’-негативные ХМПЗ – группа болезней, включающая в себя эритремию (истинную полицитемию, ИП), эссенциальную тромбоцитемию (ЭТ) и идиопатический миелофиброз (ИМФ). Это хронические лейкозы с поражением на уровне клетки-предшественницы гемопоэза с характерной для опухоли неограниченной пролиферацией этой клетки, потомки которой дифференцируются по всем росткам кроветворения. При этом для эритремии свойственно преобладание красного ростка, для эссенциальной тромбоцитемии – мегакариоцитов и тромбоцитов. Классические ХМПЗ и некоторые другие менее распространенные миелопролиферативные заболевания чаще всего являются приобретенными, спорадическими нарушениями гемопоэза.
Молекулярные события, лежащие в основе патогенеза ХМПЗ, связаны с дефектами генов, которые кодируют белки, ответственные за нормальное поддержание миелопоэза. Для всех ХМПЗ характерна аномальная тирозинкиназная активность.
Белок JAK2 принадлежит семейству нерецепторных тирозинкиназ (Janus-киназ), которое включает в себя четыре белка: JAK1, JAK2, JAK3 и TYK2. Для гемопоэза особое значение среди них имеет киназа JAK2, которая осуществляет передачу сигнала не только от эритропоэтина, но и от тромбопоэтина и колониестимулирующего фактора гранулоцитов (G-CSF). Функция белков JAK заключается в том, что они служат промежуточным звеном между рецепторами на мембране клетки и сигнальными молекулами (цитокинами, факторами роста и пр.). Эти молекулы, связываясь с рецепторами JAK-киназ на поверхности клетки, активируют их, что приводит к активации сигнальных путей с участием ряда белков, которые передают сигналы для транскрипции, пролиферации и дифференцировки бластных предшественников.
При появлении соматической мутации1 JAK2 (1849G/T (617V/F)) эти сигналы активируются автономно, независимо от связывания цитокина со своим рецептором, что приводит к избыточной пролиферации того или иного ростка клеток.
Ген JAK2 расположен в локусе 9р24.1. Соматическая мутация 1849G/T (617V/F) выражается в замене нуклеотида G→T в позиции 1849 (четырнадцатый экзон), которая в свою очередь приводит к замене фенилаланина (F) на валин (V) в 617 позиции аминокислотной последовательности белка.
JAK2 1849G/T (617V/F) является соматической мутацией, возникающей в гемопоэтических клетках-предшественницах. Она встречается у подавляющего большинства больных ХМПЗ, что делает эту мутацию очень удобным диагностическим маркером. Наличие точечной мутации JAK2 1849G/T (617V/F) – феномен, характерный исключительно для поражений миелоидного ростка, и не описан ни для солидных опухолей, ни для опухолей лимфоидного происхождения.
______________________________________________
1Мутация 1849G/T (617V/F) является соматической, т. е.:
- Возникает у человека спонтанно, а не передается по наследству от родителей.
- Мутантный аллель выявляется в основном в виде гетерозиготного генотипа.
- Возможно возникновение мутации через несколько лет после проведения данного анализа, следовательно, при необходимости целесообразно повторное проведение анализа.
Таблица 1. Молекулярные аномалии, связанные с «классическими» миелопролиферативными заболеваниями
|
Генетическая аномалия
|
Нозология
|
Частота, %
|
|
JAK2 1849G/T (617V/F)
|
Истинная полицитемия
|
> 95
|
|
Эссенциальная тромбоцитемия
|
50-70
|
|
Первичный миелофиброз
|
40-50
|
Мутация JAK2 1849G/T (617V/F) – диагностический маркер, при помощи которого можно проводить первичную и дифференциальную диагностику ХМПЗ, а также молекулярный мониторинг минимальной остаточной болезни (количественный тест).
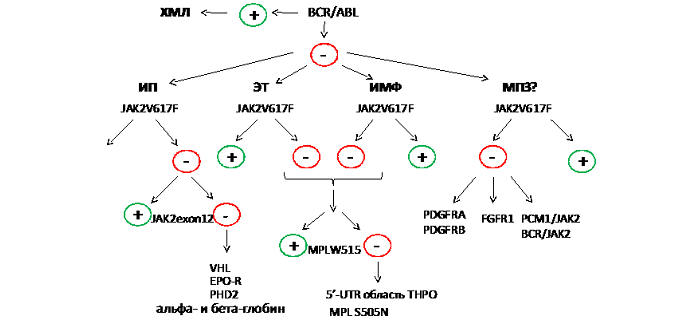
Алгоритм проведения молекулярной диагностики МПЗ (рис. 1)
Определение химерного онкогена BCR/ABL позволяет провести дифференциальный анализ хронического миелоидного лейкоза (ХМЛ) и Ph’-негативных МПЗ. Если в случае Ph’-негативных МПЗ мутация JAK2 1849G/T (617V/F) не найдена, то в случае ИП следует осуществить поиск мутаций в двенадцатом экзоне гена JAK2, а в случае ЭТ и ИМФ – мутаций MPL W515L/K. В случае отрицательного результата следует исключить возможность наследственных дефектов генов VHL, EPO-R, PHD2, THPO, MPL и генов глобинов. При редких видах МПЗ, негативных по JAK2 V617F, целесообразно осуществить поиск химерных онкотирозинкиназ.
Сейчас молекулярное исследование входит в диагностические критерии ВОЗ 2008 г., а тест на наличие мутации JAK2 стал стандартным методом диагностики ХМПЗ. Выявление мутации указывает на наличие клонального ХМПЗ и исключает возможность реактивного эритроцитоза, тромбоцитоза или миелофиброза.
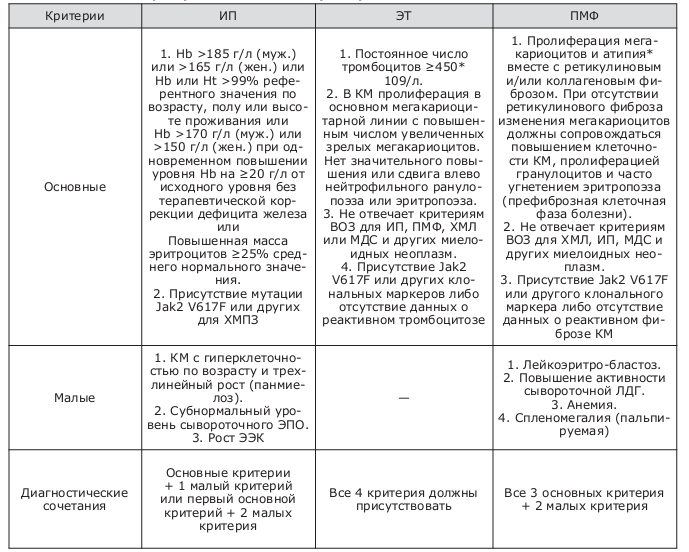
Таблица 2. Диагностические критерии ВОЗ для ХМПЗ (2008)
В настоящее время исследование на наличие мутации JAK2 1849G/T (617V/F) – необходимое условие для установления правильного диагноза и определения дальнейшей тактики ведения пациента.
Литература
- Абдулкадыров К.М., Шуваев В.А., Мартынкевич И.С. Критерии диагностики и современные методы лечения первичного миелофиброза. Вестник гематологии. - М. 2013;3(9):44-78.
- Мисюрин А.В. Молекулярный патогенез миелопролиферативных заболеваний. Клиническая онкогематология. - М. 2009;3(2):211-220.
- Саврилова А.М., Костерина А.В., Ахмадеев А.Р. Выявление мутации JAK2 V617F при хронических Ph-негативных заболеваниях. Генетика, Практическая Медицина. Инновационные Технологии в Медицине. - М. 2014;4(14):100-102.
- Материалы фирмы-производителя тест-системы.